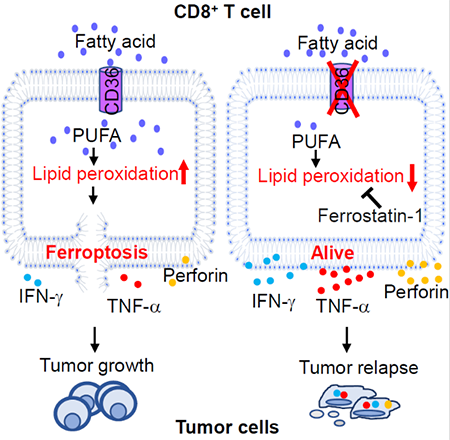
2021年3月9日,美国休斯敦卫理公会医院的易庆团队在Cell Metabolism期刊上发表文章CD36-mediated ferroptosis dampens intratumoral CD8+ T cell effector function and impairs their antitumor ability,发现肿瘤环境中的胆固醇可以诱导CD8+T细胞CD36表达的升高,进而摄取过多的脂肪酸,引发了脂质氧化损伤和铁死亡,导致了其杀伤性功能的丧失,促进了肿瘤的生长。抑制CD8+T细胞的铁死亡或者CD36的表达可以恢复CD8+T细胞的杀伤性功能,此外,通过外源输入CD36缺失的CD8+T 细胞, 结合PD1的联合免疫治疗,显著增强了CD8+T细胞的抗肿瘤作用。研究人员首先通过对黑色素肿瘤病人的CD8+T细胞进行分析,发现在存活周期短的病人中,CD8+T细胞的CD36表达更高。此外,在多发性骨髓瘤患者中,CD36的表达与肿瘤的进展正相关。而在小鼠黑色素瘤和多发性骨髓瘤模型中,CD36的表达也与肿瘤进展正相关,并且CD36缺失的小鼠肿瘤生长更慢,进一步研究发现,CD36会影响CD8+T细胞分泌杀伤性的细胞因子,从而影响CD8+T细胞的抗肿瘤作用。
在探索CD36如何调节CD8+T细胞功能的机制研究中,研究人员通过RNA-Seq和单细胞测序分析发现,CD36的表达与脂质过氧化和铁死亡密切相关。铁死亡主要是由于细胞内的脂质过氧化物的堆积引起的。CD36通过摄取肿瘤环境中的脂肪酸,尤其是多不饱和脂肪-花生四烯酸,导致了CD8+T细胞内脂质过氧化物的堆积,铁离子含量升高,铁死亡过程增多,杀伤性的细胞因子分泌减少。通过阻断CD36的表达,或者添加铁死亡的抑制剂,可以显著减少CD8+T细胞内脂质过氧化物的含量,增加杀伤性分泌分子的表达,恢复细胞的功能。为了进一步贴合临床治疗效果,研究人员对黑色素瘤负荷小鼠进行免疫治疗。试验结果表明,过继性疗法输入CD36缺失或者铁死亡抑制剂处理的CD8+T细胞,可以显著延长CD8+T细胞在体内的存活时间,获得更好的抗肿瘤效果。此外,如果与PD1进行联合免疫治疗,可以进一步抑制肿瘤的生长,延长小鼠的存活周期。综上,这项研究证明了在肿瘤发生过程中,CD8+T细胞CD36表达升高,细胞内脂质氧化物堆积,从而引起CD8+T细胞铁死亡增加,杀伤性分泌因子减少,抗肿瘤功能减弱。靶向CD36和铁死亡可能是提高CD8+T细胞免疫疗法的抗肿瘤功效的有效策略,为临床治疗提供了新思路。这一成果由美国休斯敦卫理公会医院易庆教授指导,是文章的通讯作者。文章的第一作者是马醒哲、肖柳玲、刘林涛。https://doi.org/10.1016/j.cmet.2021.02.015